Alle bewilligungspflichtigen Projekte aus der Humanforschung müssen bei der Kantonalen Ethikkommission (KEK) eingereicht werden. Dazu wird das Onlineportal BASEC verwendet.
Einreichung eines neuen Forschungsprojekts nach Humanforschungsgesetz (HFG)
Registrieren Sie sich auf der Einreicheplattform der Ethikkommissionen BASEC.
Konkretes Vorgehen
- Loggen Sie sich ein.
- Wählen Sie «Submit an application» und danach den obersten Punkt «Research Project Application Form».(Für klinische Studien mit Medizinprodukten gibt es ab dem 01.05.2021 ein eigenes Formular – siehe unten)
- Füllen Sie die Formulare gemäss Ihrem Studientyp aus. Beginnen Sie bitte auf dem ersten Screen, da die gemachten Angaben die Art und Anzahl der Felder auf den folgenden Screens beeinflussen.
- Nachdem Sie alle Angaben gemacht haben, gehen Sie auf den Upload Screen. Dieser ist gemäss Ihrem Studientyp zusammengestellt worden und verlangt automatisch alle geforderten Dokumente.
_basec_submit_an_application.png.zhweb-transform/content-image-large/(1)_basec_submit_an_application.1627357758169.png)
Probleme mit BASEC?
Konsultieren Sie die Frequently Asked Questions Sektion.
Häufigste Fehler bei der Einreichung
Bei den Einreichungen sehen wir häufig ähnliche Fehler, die zu Rückweisungen und im schlimmsten Fall zu Ablehnungen führen können. Bitte versuchen Sie diese Fehler bereits beim Erarbeiten der Unterlagen zu vermeiden. Holen Sie sich die Unterstützung Ihrer CTU. Falls Sie über wenig Methodik- oder Statistikkenntnisse verfügen, fragen Sie eine/n Expertin/Experten auf dem Gebiet. Lassen Sie Ihre Studieninformation von einem Laien auf Verständlichkeit gegenlesen.
Gute Forschung ist eine Teamleistung.
Allgemein
- Verwendung von falschen oder veralteten Vorlagen. Gehen Sie auf www.swissethics.ch und laden Sie die korrekte und aktuelle Vorlage herunter.
- Falsche Studieneinteilung. Wenn eine protokollbedingte Intervention vorgenommen und deren Wirkung auf Teilnehmende beurteilt wird, so ist es ein klinischer Versuch und keine Datenerhebung. Wenn Personen nicht rechtsgültig eingewilligt haben, dass ihre Daten/Proben für Forschung verwendet werden, dann ist keine Weiterverwendung mit Einwilligung, sondern ein Antrag auf eine Artikel 34 HFG Ausnahmebewilligung.
- Ein Einwilligungssurrogat nach Artikel 34 HFG darf nicht prospektiv erteilt werden.
Protokoll
- Überschreiben alter Protokolle, die «damals angenommen worden sind» sind oft veraltet und die Überarbeitung fehleranfällig. (z.B. gab es 2024 zahlreiche Änderungen aufgrund der Verordnungsrevisionen)
- Fehlende (Arbeits)hypothese. (Falls Sie hypothesengenerierenden Forschungsprojekte haben, explizit darauf hinweisen.) Fragen Sie bei Ihrem/Ihrer Experten/Expertin für Methodologie nach, falls Sie dabei unsicher sind.
- Zu viele und/oder zu ungenau formulierte wissenschaftliche Fragestellungen (s.o.), die so nicht beurteilbar sind und zu einer Ablehnung führen können.
- Unklar, wer für was zuständig ist. Es gibt pro Projekt ein Sponsor und pro Studienzentrum eine Prüfperson (klinische Versuche) bzw. eine Projektleitung (nicht-klinische Forschungsprojekte). Diese beiden Rollen können in einer Person vereint sein. Aufgaben können geteilt werden, Verantwortung nicht. (Assistenzärztinnen und -ärzte sind noch nicht zur Berufsausübung in eigener fachlicher Verantwortung befähigt und dürfen noch nicht Sponsor oder Prüfperson/Projektleitung sein.)
- Das Prüfen von Ein- und Ausschlusskriterien (Screening) wird vor erfolgter Aufklärung und Einwilligung vorgenommen. Das ist rechtlich nicht erlaubt, da eine Studienhandlung, für die es eine Einwilligung braucht.
- Es wird «Anonymisierung» geschrieben aber «Verschlüsselung» (Pseudonymisierung) gemeint. Solange ein Schlüssel existiert, sind die Daten/Proben per Definition nicht anonymisiert, auch wenn kein Zugang zum Schlüssel besteht. Ausserdem: Sobald die Daten/Proben ohne unverhältnismässig hohen Aufwand rückverfolgbar sind, sind sie nicht anonymisiert. Eine solide (rechtsgültige) Anonymisierung ist selten und z.T. nicht möglich! (siehe auch hier)
- Artikel 34: oft wird die Tabelle mit den Anzahl Fällen gelöscht bzw. eine alte Protokollversion verwendet, in welcher die Tabelle fehlt.
Aufklärung/Einwilligung (ICF)
- Viele Fachwörter und bildungssprachliche Ausdrücke. ICF wurde nicht von einer fachfremden Laienperson gegengelesen.
- Verwendung von Schachtelsätzen
- (Orthographische und grammatische Fehler monieren wir in der Regel nicht, ausser, sie entstellen den Sinn oder erschweren das Lesen des Textes.)
Verträge
- Fehlende Verträge bei multizentrischen Studien. Eine Zusammenarbeit und/oder ein Austausch von Daten und Proben muss vertraglich geregelt sein, sonst bekommen Sie im schlimmsten Fall (juristischen) Ärger mit Ihrer Institution. Klären Sie zudem ab, wie Ihre Institution Verträge handhabt. In der Regel prüft diese der Rechtsdienst vor der Freigabe. Klären Sie ab, ob Sie allein zeichnungsberechtigt sind oder ob noch jemand anderes mitunterzeichnen muss. Verstösse gegen Unterschriftsregelungen haben i.d.R. arbeitsrechtliche Konsequenzen.
Register-Biobanken-Reglemente
- Bei Studien, in welchen Datenregister oder Biobanken erstellt werden, fehlen häufig das entsprechende Reglement dazu. Vorlagen dazu gibt es auf www.swissethics.ch (auch auf unserer Seite verlinkt)
Rechnungsadresse
- Bitte prüfen Sie, ob innerhalb Ihrer Institution eine Kostenstelle vorhanden ist. Falls ja, geben Sie die spezifische Kostenstelle als Rechnungsadresse an.
Einreichung einer klinischen Studie mit Medizinprodukten oder In-vitro-Diagnostika
1. Loggen Sie sich im BASEC ein.
2. Wählen Sie «Research Project apllication form for Medical Devices / In vitro Diagnostic Medical Devices»
3. Füllen Sie die Formulare aus. (Beginnen Sie bitte auf dem ersten Screen, da die gemachten Angaben die Art und Anzahl der Felder auf den folgenden Screens beeinflussen.)
4. Nachdem Sie alle Angaben gemacht haben, gehen Sie auf den Upload Screen. Dieser ist gemäss Ihrem Studientyp zusammengestellt worden und verlangt automatisch alle geforderten Dokumente.
Dabei besonders zu beachten:
Gesuche der Kategorien C1, C2 und C3 müssen gleichzeitig auch bei Swissmedic eingereicht werden.
Sie erhalten bei allen Medizinproduktestudien/In-vitro-Diagnostikastudien innerhalb von 10 Tagen eine Bestätigung, dass die Unterlagen vollständig sind oder eine Mängelliste. Um diese Mängelliste zu beheben haben Sie 10 Tage Zeit. ACHTUNG! Sollten Sie diese Frist nicht einhalten können, so wird auf das Gesuch nicht eingetreten!
Sobald die Ethikkommission ein formal korrektes Gesuch hat, wird über dieses innerhalb von 40 Tagen entschieden. Bei Nachfragen oder inhaltlichen Mängeln geht das Gesuch zurück an den Sponsor. Dieser erhält eine Frist, um Fragen zu beantworten und Mängel zu beheben Während dieser Bearbeitungszeit steht für die KEK die Bearbeitungsfrist still (sog. «clock-stop»).
Einreichung eines Forschungsprojekts mit humanen embryonalen Stammzellen
Das BASEC ist primär auf Forschungsanträge gemäss Humanforschungsgesetz (HFG) ausgerichtet. Wenn Sie einen Antrag für Forschung mit humanen embryonalen Stammzellen einreichen möchten, verwenden Sie bitte auf BASEC das Formular für eine allgemeine Anfrage: Submit an application → Clarification of responsibility / Support Request → Type: «Research Project which involves embryos in accordance with StRA» .
So erhalten Sie eine «Req-yyyy-xxxx» Nummer als Referenz und die Möglichkeit, die notwendigen Dokumente einzureichen.
Bei Unklarheiten zum Vorgehen erkundigen Sie sich am besten direkt bei uns. Wir helfen Ihnen gerne weiter.
_basec_submit_an_application_stemcells.png.zhweb-transform/content-image-large/(2)_basec_submit_an_application_stemcells.1627357759704.png)
Liste der Ethikkommissionen und ihre Zuständigkeit
| Ethikkommission Bern | BE sowie deutschsprachige Teile von FR & VS |
|---|---|
| Commission cantonale d'éthique de Genève | GE |
| Ethikkommission Nordwest- und Zentralschweiz EKNZ | AG, BL, BS, JU, LU, NW, OW, SO, SZ, UR, ZG |
| Ethikkommission Ostschweiz EKOS | AI, AR, SG, TG |
| Commissione d'etica Ticino | TI |
| Commission cantonale d'éthique du Vaud | NE, VD sowie frankophone Teile von FR & VS |
| Kantonale Ethikkommission Zürich | GL, GR, SH, ZH, Fürstentum Liechtenstein |
Arbeitsablauf innerhalb der EthikkommissionNachdem
- Nachdem Sie Ihr Gesuch bei der KEK eingereicht haben, erhalten Sie eine Eingangsbestätigung und wir eine Benachrichtigung.
- Innerhalb von 7 Tagen wird eine Vollständigkeits- und grobe Qualitätsprüfung durch das wissenschaftliche Sekretariat durchgeführt. Wir prüfen, ob die Einteilung stimmt und eine beurteilbare Fragestellung mit Hypothese vorhanden ist. Wir überprüfen zudem, ob alle Unterlagen vorhanden und in einer prüfbaren Qualität sind. Wenn einer der Punkte nicht erfüllt ist, melden wir uns bei den Antragstellenden, ansonsten erhalten Sie eine Vollständigkeitsmeldung.
- Das Gesuch kommt dann auf eine Warteliste. Diese ist wegen einem Rückstau an Gesuchen im Moment ziemlich lang, daher bitten wir Sie um etwas Geduld.
- Wenn das Gesuch dran ist, wird eine Person aus dem Wissenschaftliche Sekretariat eine vertiefte Prüfung auf Vollständigkeit der Inhalte, Konsistenz der Angaben, Lesbarkeit der Teilnahmeinformationen und Einhaltung von Gesetz und Regulatorien vornehmen. Das kann je nach Art und Umfang des Gesuchs eine halbe bis mehrere Stunden dauern.
- Anschliessend werden Wissenschaftlichkeit und Ethik des Antrags je nach Studientyp durch den Präsidenten, ein Dreiergremium oder durch die ganze Kommission geprüft.
- Anschliessend wird ein Beschluss oder Zwischenentscheid mit Bedingungen ausgestellt und Ihnen per Post zugestellt. (Ja, wir wissen, dass es elektronische Unterschriften gibt, aber diese kann der Kanton noch nicht rechtsgültig ausstellen...) Eine Kopie des Entscheids erhalten Sie zudem per BASEC Mail. Allenfalls gehen Kopien an Swissmedic oder das BAG. Die Person aus dem Wissenschaftlichen Sekretariat, die die Vorprüfung gemacht hat, wird als Ansprechperson für Rückfragen angegeben. Die Personen aus der Ethikkommission, die an der Beurteilung beteiligt waren, sind ebenfalls auf dem Beschluss aufgeführt.
- Bei einem Zwischenbescheid habe Sie Zeit, allfällige Bedingungen oder Auflagen zu erfüllen oder zu argumentieren, weshalb das nicht nötig oder nicht möglich ist. Bei Unklarheiten können Sie sich an die Kontaktperson auf dem Beschluss wenden. Fachfragen, die von dieser Person nicht beantwortet werden kann, werden an die Kommission weitergeleitet.
- Nachdem Sie die revidierten Unterlagen eingereicht haben, werden diese innerhalb von 30 Tagen geprüft. Falls noch Nachbesserungen notwendig sind, wird sich das wissenschaftliche Sekretariat bei Ihnen melden, ansonsten wird ein positiver (oder allenfalls negativer) Entscheid ausgestellt.
Mehrere Studienzentren
Wenn ein Forschungsprojekt nach dem gleichen Prüfplan an mehreren Zentren durchgeführt wird, sind allenfalls mehrere Ethikkommissionen beteiligt. Für die Bewilligung ist jene Ethikkommission zuständig, die am Tätigkeitsort der das Projekt koordinierenden Person zuständig ist.
Diese Ethikkommission wird dann «Leit-Ethikkommission» genannt. Die anderen Ethikkommissionen sind «beteiligte Ethikkommissionen». Die Leit-Ethikkommission koordiniert das Bewilligungsverfahren mit den beteiligten Ethikkommissionen. Der Beschluss der Leit-Ethikkommission umfasst alle eingereichten Zentren.
Im folgenden Dokument wird das multizentrische Verfahren im Detail erklärt und auch auf Sonderfälle eingegangen:
Einreichung eines multizentrischen Projekts
Ein Projekt mit mehreren Zentren muss ein Gesuch nur einmal in BASEC bei der Leit-Ethikkommission eingereicht werden. Es gibt nur eine BASEC Nummer, die für alle Zentren gilt.
Für die beteiligten Zentren müssen die lokalen Unterlagen ebenfalls unter BASEC hochgeladen werden. Auf Screen 1 müssen Sie dazu «several sites in Switzerland» und dann die beteiligten Ethikkommissionen anwählen. Wenn mehrere Zentren in unserem Zuständigkeitsgebiet liegen, müssen Sie die Ethikkommission Zürich auch bei den beteiligten Ethikkommissionen nochmals auswählen. Dadurch werden mehr Uploadscreens freigeschaltet, auf denen die lokalen Unterlagen hochgeladen werden müssen.
Wenn nach der Bewilligung zusätzliche Zentren hinzukommen, so sind diese als Amendment einzureichen.
Änderung bei der koordinierenden Person
Wenn eine koordinierende Prüfperson / Projektleitung ändert, so hat das keinen Einfluss auf die bereits gewählte Leit-Ethikkommission. (Ausnahme: die Studie wurde noch nicht begutachtet.) Selbst wenn am Ende kein Prüfzentrum im Zuständigkeitsbereich der gewählten Leit-Ethikkommission eröffnet wird, bleibt die Leit-Ethikkommission dieselbe.
Fristen
Das Humanforschungsgesetz gibt Fristen vor, in denen die Ethikkommission ein Gesuch bearbeiten sollte. Es handelt sich dabei um Ordnungsfristen. Bedenken
Sie, dass die Frist während offizieller Feiertage stillsteht.
Achtung: Bei der Fristsetzung im Sinne des Art. 12 Abs. 1 KlinV-Mep wegen formaler Mängel der Gesuchsunterlagen für eine Medizinproduktestudie handelt es sich um eine Verfallsfrist. Wenn diese Frist vom Antragsteller nicht eingehalten wird, wird auf das Gesuch nicht eingetreten.
Projekte mit einem Zentrum in der Schweiz:
- Sieben Tage Vollständigkeitsprüfung
- plus 30 Tage inhaltliche Prüfung bis zum Erstentscheid
→ also innerhalb von 37 Tagen nach Eingang
Gesuche mit mehreren Zentren in verschiedenen Kantonen (multizentrisches Verfahren)
Plus 15 Tage
→ also innerhalb von 52 Tagen nach Eingang
Gesuche, die eine Stellungnahme zum Strahlenschutz vom Bundesamt für Gesundheit (BAG) benötigen
Plus 15 Tage
→ also innerhalb von 52 Tagen nach Eingang
(→ innerhalb von 67 Tagen nach Eingang, falls im multizentrischen Verfahren)
Fristen bei klinischen Studien mit Medizinprodukten
- Zehn Tage Vollständigkeitsprüfung (+5 Tage bei multizentrischen Anträgen)
- Frist für den Sponsor: Zehn Tage, um Unterlagen zu vervollständigen (Verfallsfrist!!!) (auch hier +5 Tage bei multizentrischen Anträgen)
- danach 40 Tage für die inhaltliche Prüfung bis zum Entscheid (falls das Gesuch wegen Rückfragen oder Mängeln an den Antragsteller zurückgeht, steht die Frist für die KEK still.)
→ also innerhalb von maximal 60 Tagen nach Eingang
Fristen für die Antragstellenden bei klinischen Versuchen nach Kapitel 2 KlinV (Art. 23 und 23a KlinV)
Bei klinischen Versuchen der Kategorie B und C muss das Gesuch innerhalb von zwei Jahren nach Erteilung der Bewilligung durch die erste Behörde auch der zweiten Behörde eingereicht werden. Beispiel: das Swissmedic Votum liegt bei einer Arzneimittelstudie Kategorie C vor und muss innerhalb von zwei Jahren auch bei der zuständigen Ethikkommission eingereicht werden.
Die erste teilnehmende Person muss innerhalb von zwei Jahren nach Erteilung der letzten erforderlichen Bewilligung eingeschlossen werden. Einschluss ist die erste Unterschrift auf der ersten Einverständniserklärung (ICF). Die Meldung erfolgt über BASEC.
Wenn eine der beiden Fristen nicht eingehalten wird, verfällt die Bewilligung. Anträge auf Verlängerung sind möglich.
Wegen anhaltend hohen Gesuchseingängen bei gleichbleibendem Personalbestand können im Moment die Ordnungsfristen nicht eingehalten werden. Es kommt zu Verzögerungen bis zu vier Wochen. Wir bitten Sie um Verständnis.
Bitte schreiben Sie uns zeitnahe zur Einreichung eine E-Mail mit Begründung, falls die Ordnungsfristen unbedingt eingehalten werden müssen (ablaufende Grants, Erneuerungen von Anstellungen etc.)
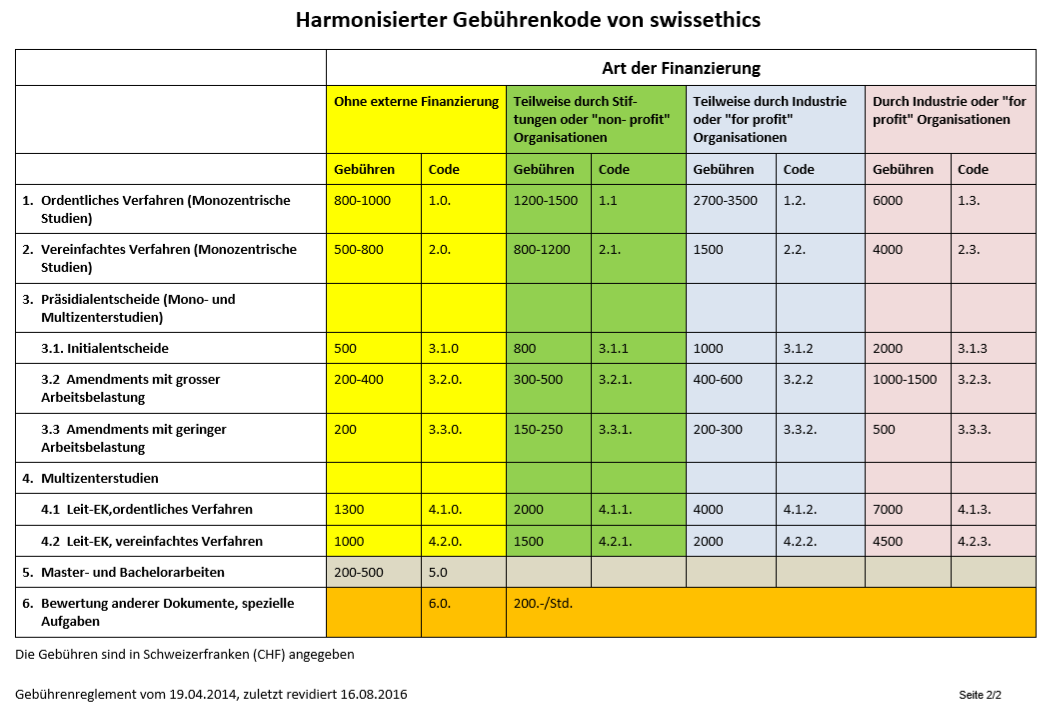
Kosten
Die Kosten sind von der Art der Finanzierung und vom
Begutachtungsverfahren abhängig. Massgebend ist auch, ob eine oder mehrere Ethikkommissionen am Entscheid beteiligt sind.
Verwenden Sie die Akkordeon-Bedienelemente, um die Sichtbarkeit der jeweiligen Panels (unterhalb der Bedienelemente) umzuschalten.
Art. 1 Prinzip
¹Die Ethikkommissionen für die Forschung am Menschen (swissethics) erheben für die Leistungen, die sie in ihrer Funktion als Bewilligungsbehörde im Bereich des Humanforschungsgesetzes (HFG) vom 30. September 2011 erfüllen, Gebühren.
²Die Gebühren sollen zur Kostendeckung des Betriebs jeder Ethikkommission und deren Sekretariate beitragen.
Art. 2 Gebührenpflicht
Jede von der Ethikkommission geforderte administrative Dienstleistung ist gebührenpflichtig.
Art. 3 Berechnung der Gebühren
¹Die Gebühren werden gemäss einem für alle Mitglieder von swissethics harmonisierten Tarifsystem berechnet. Die Tariftabelle sieht Bandbreiten vor, die jede Ethikkommission entsprechend dem erbrachten Aufwand anwenden kann.
²Das Tarifsystem entspricht den Art. 5-7 der Organisationsverordnung (OV-HFG) zum Gesetz (HFG).
Art. 4 Rechnungsstellung
¹Die Ethikkommission stellt ihre Rechnung an den Sponsor sobald der Entscheid übermittelt worden ist.
²Bei Multizenterstudien stellt jede beteiligte Ethikkommission ihre Rechnung an den Sponsor der Studie.
³Im Fall von Streitigkeiten bezüglich der Rechnung muss die vorgesehene kantonale Rekursinstanz angerufen werden.
Art. 5 Zahlungsfristen
¹Die Zahlungsfrist beträgt 30 Tage ab Inkrafttreten des Entscheids der Ethikkommission.
²Die Ethikkommission kann in besonderen Fällen eine Fristverlängerung gewähren.
³Nach Ablauf der Frist beträgt der jährliche Verzugszins 5
Rechtliche Grundlagen
Verwenden Sie die Akkordeon-Bedienelemente, um die Sichtbarkeit der jeweiligen Panels (unterhalb der Bedienelemente) umzuschalten.
Bitte geben Sie uns Feedback
Ist diese Seite verständlich?
Vielen Dank für Ihr Feedback!
Kontakt
Kantonale Ethikkommission